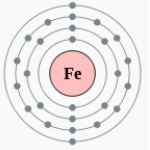
ইলেক্ট্রন বিন্যাস ২,৮,১৪, ২
 |
|
ইলেক্ট্রন বিন্যাস ২,৮,১৪, ২ |
লৌহ
ইংরেজি
Iron।
একটি রাসায়নিক মৌলিক পদার্থ। এর স্বাভাবিক রং রুপালি ধূসর।
এই ধাতুটি চৌম্বক গুণসম্পন্ন। স্বাভাবিক দশায় বেশ কঠিন। আঘাতের দ্বারা বা চাপ
প্রয়োগে একে বিভিন্ন আকার প্রদান করা যায়।
এর প্রতীক Fe,
গ্রিক
ferrum
শব্দ থেকে এই প্রতীক গ্রহণ করা
হয়েছে। এর পারমাণবিক সংখ্যা ২৬, পারমাণবিক ওজন ৫৫.৮৪৫। এর ইলেক্ট্রন বিন্যাস
২,৮,১৪, ২।
প্রকৃতিতে স্বাভাবিক তাপমাত্রায় এটি কঠিন দশায় থাকে। এর গলনাঙ্ক ১৫৩৮ ডিগ্রি সেন্টিগ্রেড (২৮০০ ডিগ্রি ফারেনহাইট), স্ফুটনাঙ্ক ২৮৬২ ডিগ্রি সেন্টিগ্রেড (৫১৮২ ডিগ্রি ফারেনহাইট)। কঠিন দশায় এর ঘনত্ব ৭.৮৭৪ গ্রাম/সেন্টিমিটার -৩।
আইসোটোপ
প্রকৃতিতে এর চারটি স্থিতিশীল আইসোটোপ পাওয়া যায়। এগুলো হলো―
54Fe : প্রকৃতিতে এর পরিমাণ ৫.৮৪৫%
56Fe : প্রকৃতিতে এর পরিমাণ ৯১.৭৫৪%
57Fe : প্রকৃতিতে এর পরিমাণ ২.১১৯%
58Fe : প্রকৃতিতে এর পরিমাণ ০.২৮২%
রাসায়নিক ধর্ম
লৌহ একটি বিজারক ধাতু। অবস্থাভেদে ২+, ৩+ বা +৬ দশায় জারিত হয়।
২+ দশায় জারিত লৌহকে ফেরাস (ferrous) বলা হয়। যেমন FeCl2 (ফেরাস ক্লোরাইড)। এদের রং হয়ে থাকে হালকা সবুজ বর্ণের হয়। এই যৌগগুলো বেশ স্থায়ী। এই যৌগগুলো সাধারণত আর্দ্র বিশ্লেষিত হয় না। তবে এরা অক্সিজেন, ওজোন, হাইড্রোজেন, হাইড্রোজেন-পার-অক্সাইড, নাইট্রিক এ্যাসিড ইত্যাদি দ্বারা জারিত হয়ে ফেরিক যৌগ তৈরি করে।
৩+ দশায় জারিত হলে তাকে বলা ফেরিক (ferric)। যেমন FeCl3 (ফেরিক ক্লোরাইড)। হালকা হলুদ থেকে বাদামি বর্ণের আধিক্য লক্ষ্য করা যায়। ফেরাস-যৌগের চেয়ে জম স্থায়ী।
৬+ দশায় জারিত হয়ে লৌহের জটিল যৌগ তৈরি হয়। এই জাতীয় একটি যৌগ হলো K2FeO4 [পটাসিয়াম ফেরেট (potassium ferrate)]।