 নিউট্রন
নিউট্রন ইংরেজি : Proton
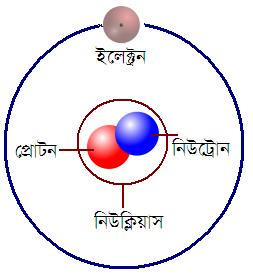
পরমাণুর একটি মৌলিক কণা। এই কণাটি একটি তড়িৎ আধানহীন। এর প্রতীক =n0।
পরমাণুর তিনটি মৌলিক কণার মধ্যে একটি। অপর দুটি কণা হলো— প্রোটন ও ইলেক্ট্রন। পরমাণুর কেন্দ্রে এক বা একাধিক প্রোটন থাকে। এর ভর প্রোটনের চেয়ে সামান্য বেশি। হাইড্রোজেন ছাড়া সকল পরমাণুর কেন্দ্রে নিউট্রন থাকে।
এটি একটি অতিপারমাণবিক কণার যৌগিক কণা। আধুনিক পদার্থ বিজ্ঞানে প্রোটন হলো হ্যাড্রোন (hadron)-এর অন্তর্গত ব্যারিয়ন শ্রেণির যৌগিক কণা। দুটি ডাউন কোয়ার্ক এবং একটি আপ কোয়ার্ক দিয়ে নিউট্রন গঠিত হয়। এর দুটি ডাউন কোয়ার্কের আধান হয় -১/৩-১/৩= -২/৩। এর সাথে ২/৩ (আপ কোয়ার্ক) থাকায় এর আধান মান হয় ০।
১৯২০ খ্রিষ্টাব্দে রাদার্ডফোর্ড (Ernest Rutherford) প্রোটনের নামকরণ করেন। এই সময় তিনি পরমাণুর কেন্দ্রে আধানবিহীন একটি কণা থাকার সম্ভাবনার কথা বলেন। ১৯৩২ খ্রিষ্টাব্দে বিজ্ঞানী চ্যাডউইক পরামাণুতে এই আধাবিহীন কণার (নিউট্রন) অস্তিত্ব প্রমাণ করেন। এই কারণে চ্যাডউইক-কে নিউট্রনের আবিষ্কারক বলা হয়।
একটি পরমাণুতে প্রোটন ও
নিউট্রনের সংখ্যাকে বলা হয় পারমাণবিক ভর সংখ্যা (atomic
mass number)।
যেমন—কার্বনের
পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে। তাই এর পারমাণবিক ভর সংখ্যা
হবে ১২।
কোনো কোনো পদার্থের পরমাণুতে নিউট্রোনের সংখ্যা প্রোটনের চেয়ে বেশি থাকতে দেখা যায়। ফলে ওই পদার্থের পারমাণবিক ভর সংখ্যা বৃদ্ধি পায়। যখন দুটি পরমাণুর পারামাণবিক সংখ্যা (প্রোটন সংখ্যা) একই থাকে, কিন্তু একটি পরমাণুর নিউট্রন সংখ্যা বেশি হয়, তখন ওই দুটি পরমাণুর পারামণিবক ভর সংখ্যা একই থাকে না। যে সকল পরমাণুর প্রোটন সংখ্যা একই থাকে কিন্তু নিউট্রন সংখ্যা ভিন্ন হয়, তখন ওই পরমাণুগুলো পরস্পরের আইসোটোপ হিসাবে বিবেচনা করা হয়। যেমন— কার্বনের পরমাণুতে কার্বনের পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে, তাদের পরিচয় হয় কারন-১২ নামে। কিন্তু যখন কোনো পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৮টি থাকে, তখন তা কার্বন-১৪ নামে পরিচিত হয়। এই বিচারে কার্বন-১২ এবং কার্বন-১৪ পরস্পরের আইসোটোপ হবে।
আবার যখন একাধিক পরমাণুর নিউট্রন সংখ্যা একই থাকে, কিন্তু প্রোটন সংখ্যা ভিন্ন হয়, তখন তাদেরকে আইসোটোন (isotones) বলা হয়। যেমন- 1H2 এবং 2He3 পরস্পরের আইসোটোন। উভয় পরমাণুর নিউট্রন সংখ্যা ১টি কিন্তু পারমাণবিক ভর সংখ্যা ভিন্ন।