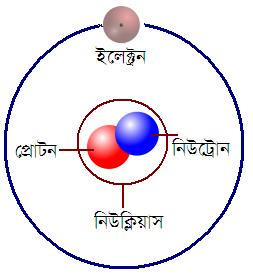
 ইলেক্ট্রোন
ইলেক্ট্রোনকোন কক্ষপথে ইলেক্ট্রোন প্রবেশের ক্ষেত্রে ইলেক্ট্রোন সর্বপ্রথম নিম্নশক্তির কক্ষপথ পূর্ণ করে, তারপর উচ্চশক্তির অরবিটালে প্রবেশ করে। এই শক্তিক্রমগুলো হলাে- 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d ।
১৯২৯ খ্রিষ্টাব পাউলি্ বিভিন্ন মৌলের পারমাণবিক বর্ণ বিশ্লেষণের মাধ্যামে পরমাণুতে ইলেক্ট্রোনগুলোর উপস্থিতি বিষয়ক একটি বিধি দিয়েছেন। সাধারণভাবে এই বিধিকে বলা হয়- পাউলির বর্জন বিধি। পাউলর বর্জনবিধি অনুসারে একই কক্ষে একই চক্রণমান যুক্ত ইলেক্ট্রন একই কক্ষে থাকতে পারে না। কিন্তু এই মান ভিন্ন হলে একটি কক্ষে ইলেক্ট্রন আবর্তিত হতে পারবে। যেমন― হিলিয়ামের পরমাণুর প্রথম কক্ষপথে দুটি ইলেক্ট্রন থাকে। এদের প্রথম তিনটি কোয়ান্টাম মান একই কিন্তু এদের চক্রণের দিক ভিন্ন, তাই একই কক্ষে দুটি ইলেক্ট্রন থাকতে পারে।
কোন অণু বা পরমাণুর অর্বিটালগুলোতে কতটি করে ইলেক্ট্রন রয়েছে তা বিশেষ উপায়ে প্রকাশিত রূপই হচ্ছে ইলেক্ট্রন বিন্যাস। পরমাণুর ইলেকট্রন বিন্যাসের উপরে ঐ পরমাণুর যোজনী নির্ভর করে। ইলেক্ট্রন বিন্যাসের বৈশিষ্ট্যের উপরে দাঁড়িয়ে আছে সমযোজী বন্ধনের ভিত্তি। এই শক্তিস্তরগুলোকে কয়েকটি সাংকেতিক নামে চিহ্নিত করা হয়। এই নামগুলো হলো − । পরমাণুর কেন্দ্র থেকে এই শক্তিস্তরগুলোকে ক্রমিক সংখ্যা দ্বারা নির্ধারিত হয়। এই বিচারে শক্তিস্তরগুলোর মান হয়