বানান বিশ্লেষণ: প্+অ+র্+ম্+আ+ণ্+উ
উচ্চারণ: pɔ.ro.ma.nu (প.রো.মা.নু)
ঊর্ধ্বক্রমবাচকতা { | বস্তু | দৈহিক সত্তা | সত্তা |}
ইংরেজি : atom ।
অণুকে বিশ্লেষণ করলে পরমাণু পাওয়া যায়। পরমাণু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে কিন্তু এর স্বাধীন অস্তিত্ব নেই (নিষ্ক্রিয় গ্যাসগুলোর ক্ষেত্রে ব্যতিক্রম)। পদার্থ বিজ্ঞান ও রসায়নবিজ্ঞানের সূত্রে বলা হয়- 'মৌলিক পদার্থের এমন একটি ক্ষুদ্রতম কণা, যার স্বাধীন অস্তিত্ব নাই, কিন্তু রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে।
খ্রিষ্টপূর্ব-কালে ভারতীয় দার্শনিক কণাদের সূত্রে, প্রাচীন ভারতে পরমাণু সম্পর্কে ধারণা জন্মেছিল বস্তুর অতি ক্ষুদ্র কণা হিসাবে। পরমাণু (পরম +অণু) অর্থে, বস্তুর এমন একটি ক্ষুদ্র অণু (কণা), যা তার সর্বশেষ বিভাজিত অংশ। অর্থাৎ পদার্থের পরম ক্ষুদ্রতম কণাই হলো পরমাণু। খ্রিষ্ট-পূর্ব পঞ্চম শতাব্দীতে গ্রিক দার্শনিক লুসিপাস ও তাঁর শিষ্য ডেমোক্রিটাস বলছিলেন, প্রত্যেক বস্তু অতি ক্ষুদ্র অবিভাজ্য সূক্ষ্ম কণার সমষ্টি মাত্র। ডেমোক্রিটাস এর নাম দিয়েছিলেন άτομος (ইংরেজি : atomos , অদৃশ্য)। গ্রিক ά অর্থ নয় এবং τέμνω (temnō, "I cut" আমি কাটি)। এই দুটি শব্দের সমন্বয়ে গ্রিক শব্দ এটম-এর অর্থ দাঁড়িয়েছিল অকর্তনযোগ্য, ভিন্নার্থে অদৃশ্য।
পরমাণুকে বিভাজিত করলে তিনটি অতি-পারমাণবিক কণা (subatomic particles) পাওয়া যায়। এই কণা তিনটি হলো— ইলেক্ট্রন, প্রোটন ও নিউট্রন। এর ভিতরে ইলেক্ট্রন হলো মৌলিক ফার্মিয়ন (Elementary fermions) কণার অন্তর্গত এক প্রকার লেপ্টোন (lepton)। পক্ষান্তরে প্রোটন ও নিউট্রন হলো— যৌগিক কণা (composite particles)। এই যৌগিক কণা দুটো একত্রিত হয়ে একটি বড় ধরনের যৌগিক কণা (composite particles) সৃষ্টি করে এবং পরমাণুর কেন্দ্রে অবস্থান করে। একে বলা হয় নিউক্লিয়াস বা নিউক্লেই (nuclei)। উল্লেখ্য, হাইড্রোজেন ছাড়া অন্য সকল নিউক্লেই-তে নিউট্রন থাকে।
একটি পরমাণুতে অবস্থিত প্রোটনের সংখ্যাকে ওই পরমাণুর পারমাণবিক সংখ্যা (atomic number) বলা হয়। যেমন সোডিয়ামের পরমাণুতে প্রোটন থাকে ১১টি। তাই সোডিয়ামের পারমাণবিক সংখ্যা ১১। আবার একটি পরমাণুতে প্রোটন ও নিউট্রনের সংখ্যাকে বলা হয় পারমাণবিক ভর সংখ্যা (atomic mass number)। যেমন কার্বনের পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে।। তাই এর পারমাণবিক ভর সংখ্যা হবে ১২।
কোনো কোনো পদার্থের পরমাণুতে নিউট্রোনের সংখ্যা প্রোটনের চেয়ে বেশি থাকতে দেখা যায়। ফলে ওই পদার্থের পারমাণবিক ভর সংখ্যা বৃদ্ধি পায়। যখন দুটি পরমাণুর পারামাণবিক সংখ্যা (প্রোটন সংখ্যা) একই থাকে, কিন্তু একটি পরমাণুর নিউট্রন সংখ্যা বেশি হয়, তখন ওই দুটি পরমাণুর পারামণিবক ভর সংখ্যা একই থাকে না। যে সকল পরমাণুর প্রোটন সংখ্যা একই থাকে কিন্তু নিউট্রন সংখ্যা ভিন্ন হয়, তখন ওই পরমাণুগুলো পরস্পরের আইসোটোপ (isoptopes) হিসাবে বিবেচনা করা হয়। যেমন— কার্বনের পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে, এই অবস্থায় এই কার্বনকে 'কার্বন-১২' নামে অভিহিত করা হয়। কিন্তু যখন কোনো কার্বন পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৮টি থাকে, তখন ওই কার্বনকে 'কার্বন-১৪' নামে অভিহিত করা হয়। এই বিচারে কার্বন-১২ এবং কার্বন-১৪ পরস্পরের আইসোটোপ হবে।আবার যখন একাধিক পরমাণুর নিউট্রন সংখ্যা একই থাকে, কিন্তু প্রোটন সংখ্যা ভিন্ন হয়, তখন তাদেরকে আইসোটোন (isotones) বলা হয়। যেমন- 1H2 এবং 2He3 পরস্পরের আইসোটোন। উভয় পরমাণুর নিউট্রন সংখ্যা ১টি কিন্তু পারমাণবিক ভর সংখ্যা ভিন্ন।
আবার কোনো কোনো পরমাণুর
পারমাণবিক ভর সংখ্যা সমান হওয়ার পরও দেখা যায়, পরস্পরের প্রোটনের সংখ্যা ভিন্ন।
তখন প্রোটনের সংখ্যা ভিন্ন হওয়ার কারণে ভিন্ন ভিন্নভাবে স্বতন্ত্র পরমাণু
হিসাবে বিবেচনা করা হয়। এই রকম শর্তে পৃথক মৌলিক পদার্থের পরমাণু দুটি পরস্পরের
আইসোবার (isobars)
হবে।
যেমন তামার আইসোটোপ
29Cu64
এবং
দস্তার আইসোটোপ
30Cu64।
উভয়
আইসোটোপের পারমাণবিক ভর ৬৪, কিন্তু প্রোটন সংখ্যা যথাক্রমে ২৯ ও ৩০। তাই এই
আইসোটপ দুটো পরস্পরে আইসোবার হবে।
একাধিক
আইসোটোপ রয়েছে এমন মৌলের পারমাণবিক ভর আইসোটোপ ভেদে ভিন্ন ভিন্ন হয়। এক্ষেত্রে
সকল আইসোটোপের বিচারে ওই মৌলের একটি আপেক্ষিক একটি পারমাণবিক ভর নির্ণয়ের
প্রয়োজন হয়। বর্তমানে
কার্বন- ১২ আইসোটোপের ভরের অংশকে পারমাণবিক ভরের প্রমাণ হিসেবে গ্রহণ করা হয়ে
থাকে। কোনো মৌলের পারমাণিবক ভরকে কার্বন-১২ -এর ১/১২ অংশ দ্বারা ভাগ করলে, ওই
মৌলের আপেক্ষিক পারমাণবিক ভর পাওয়া যায়। এই কারণে আপেক্ষিক পারমাণবিক ভরের কেন
একক থাকে না।
পরমাণু গবেষণার ইতিহাস
১৮০৩-০৫ খ্রিষ্টাব্দের ভিতরে ইংরেজ পদার্থ ও রসায়ন বিজ্ঞানী জন ডাল্টন (John
Dalton) পরমাণু সম্পর্কে একটি
তত্ত্ব প্রকাশ উপস্থাপন করতে সক্ষম হন। তাঁর প্রদত্ত স্বীকার্য পাঁচটি সূত্রে
গ্রথিত। এই স্বীকার্য পাঁচটি হলো–
|
|
|
|
থমসনের পরমাণু মডেল |
একালের বিজ্ঞানীরা এই তত্তের নানাবিধ সমালোচনা করেন বটে। কিন্তু ১৮শতকের মধ্যভাগ পর্যন্ত ডাল্টনের স্বীকার্যকেই বিজ্ঞানীরা মেনে নিয়েছিলেন। কারণ তখন পর্যন্ত এই স্বীকার্য অস্বীকার করার মতো যথেষ্ঠ প্রমাণাদি উপস্থাপন করা যায় নি। ১৮৯৭ খ্রিষ্টাব্দে জে জে থমসন (J. J. Thomson,) ইলেক্ট্রন আবিষ্কার করেন। এর ফলে ডাল্টনের তৃতীয় স্বীকার্যের অংশবিশেষ (পরমাণু বিভাজিত হতে পারে না) ভুল প্রমাণিত হয়।
থমসনের পরমাণু মডেল
১৮৯৭ খ্রিষ্টাব্দে জে জে থমসন
(J.
J. Thomson,) ইলেক্ট্রন আবিষ্কার
করেন এবং একই সাথে তিনি পদার্থের ভিতর ধনাত্মক ও ঋণাত্মক আধানের বিন্যাসের
বিষয়ে ব্যাখ্যা করেন। থমসনের পরমাণু মডেলকে
Plum pudding model
নামে অভিহিত হয়ে থাকে। এই মডেল অনুসারে
পুডিং-এর ভিতরে কিশমিশ যেমন ইতস্তত বিক্ষিপ্তাকারে থাকে, পরমাণুর ভিতরে তেমনি
ধনাত্মক আধানের ভিতর ঋণাত্মক আধান বিক্ষিপ্তভাবে থাকে। এই ঋণাত্মক আধানগুলোর
ভিতরে তড়িৎ মিথস্ক্রিয়ার কারণে এরা এক এ্যাংস্ট্রম পর্যায়ের ব্যাসার্ধের কল্পিত
গোলাকৃতি পরমাণুর ভিতর বিন্যস্ত থাকে।
|
|
|
রাদারফোর্ডের পরমাণু মডেল |
রাদারফোর্ডের পরমাণু মডেল
থমসনের পরমাণু মডেল থেকে
পরমাণুর যে গঠন সম্পর্কে ধারণা পাওয়া গিয়েছিল, রাদার ফোর্ডের মডেল দ্বারা বাতিল
হয়ে যায়। ১৯০৯ খ্রিষ্টাব্দে রাদার্ডফোর্ড আলফা কণিকা বিক্ষেপণ পরীক্ষা করেন।
তিনি একটি মোটা স্বর্ণপাতের এক পার্শ্বে একটি সচল জিঙ্কসালফাইটযুক্ত পর্দাকে
সঞ্চালিত করেন। এর ফলে জিঙ্কসালফাইটযুক্ত পর্দাটির গায়ে আলোকপ্রভা সৃষ্টি হয়।
এই সময় তিনি লক্ষ্য করেন যে, অধিকাংশ আলফা কণা আদি গতিপথের বিচারে বেঁকে যায়।
এই পরীক্ষা থেকে ১৯১১ খ্রিষ্টাব্দে রাদার্ডফোর্ড একটি প্রস্তাব পেশ করেন।
প্রস্তাবে বলা হয় পরমাণুর কেন্দ্রে ধনাত্মক আধানযুক্ত ভারি বস্তু রয়েছে।
বিজ্ঞানীরা পরবরতী সময়ে এর নামকরণ করেন নিউক্লিয়াস। পরমাণুর সকল ভর পরমাণুর
নিউক্লয়াসে কেন্দ্রীভূত হয়ে আছে। এই নিউক্লিয়াসের ব্যাসার্ধ ১০-১৫
মিটার। এই নিউক্লয়াসকে কেন্দ্র করে ইলেক্ট্রনগুলো আবর্তিত হচ্ছে। তবে এই
আবর্তনশীল ইলেক্ট্রন অভিমুখ পরিবর্তন করে এবং এর ফলে ইলেক্ট্রনের ত্বরণের
পরিবর্তন ঘটছে। এই মডেল পরবর্তী সময়ে ত্রুটিপূর্ণ হিসাবে বাতিল হয়ে যায়। এরপরে
এই স্থান পূরণ করে বোরে পরমাণু মডেল।
বোর-এর পরমাণু মডেল
১৯১৩ খ্রিষ্টাব্দে নেইলস বোর
নতুন একটি মডেল উপস্থাপন করেন। তিনি দুটি স্বীকার্য দ্বারা এই মডেলকে উপস্থাপন
করেন। পরবর্তীকালে পরমাণুর অন্যান্য কণা সম্পর্কে জানা
গেছে। বর্তমানে পরমাণুর গঠন সম্পর্কে যে চিত্র পাওয়া যায় তা হলো–
১. স্থায়ী অবস্থা স্বীকার্য : পরমাণুতে ইলেক্ট্রনকে কেন্দ্র করে, কতকগুলো নির্দিষ্ট কক্ষপথে আবর্তিত হয়। ইলেক্ট্রোন নির্দিষ্ট কক্ষপথে অবস্থানকালে এরা স্থিতিশীল থাকবে, কোন বিকিরণ করবে না। বোর এদেরকে "stationary orbits" বা নিশ্চল কক্ষপথ হিসেবে আখ্যায়িত করেন। এসকল কক্ষপথের নিজস্ব শক্তি বর্তমান। একে বলা হয়েছে শক্তিস্তর। এই শক্তিস্তরগুলোকে কয়েকটি সাংকেতিক নামে চিহ্নিত করা হয়েছে। এই নামগুলো হলো− K, L, M, N। পরমাণুর নিউক্লয়াসে দিক থেকে এই বিন্যাসটি উপস্থাপন করা হয়েছে। এই বিচারে K হলো এই শক্তিস্তরের প্রথম কক্ষ। এই কক্ষের শক্তি সবচেয়ে কম। হাইড্রোজেনের পরমাণুর বিচারে প্রথম কক্ষে শক্তি বিবেচনা করা হয়েছে -13.6eV ।
যদি কোনো কারণে একটি ইলেক্ট্রোন অন্যকক্ষে চলে যেতে বাধ্য হয়, তাহলে দুটি কারণ ঘটতে পারে।১. যদি নিম্নকক্ষ থেকে উচ্চ কক্ষে ইলেক্ট্রোন প্রবেশ করে, তাহলে ওই ইলেক্ট্রোনকে বাইরের থেকে শক্তি সঞ্চয় করতে হয়।
২. যদি উচ্চ কক্ষ থেকে নিম্ন কক্ষে ইলেক্ট্রোন চলে আসে, তাহলে, তাকে বাড়তি শক্তি ত্যাগ করতে হয়।এক্ষেত্রে দুটি কক্ষের শক্তির পার্থক্যকে v প্রতীক দ্বারা প্রকাশ করা হয়। প্লাঙ্কের সূত্রানুসারে এর গাণিতিক মান দাঁড়ায়-
এখানে, h হল প্ল্যাঙ্কের ধ্রুবক। এক্ষেত্রে ইলেক্ট্রনের কৌণিক ভরবেগ L। এই L-এর মান হবে কোনো পূর্ণ সংখ্যা (n) এবং h/2π এর গুণফল। এই বিচারে সূত্রটি হবে।
২. কম্পাঙ্ক স্বীকার্য : ইলেক্ট্রন যখন একটি স্থায়ী কক্ষপথ থেকে অন্য কোনো একটি স্থায়ী কক্ষপথে যায়, তখন এটি শক্তি নির্গমন করে বা শোষণ করে। নির্গত বা শোষিত ফোটনের শক্তিস্তর দুটি শক্তির পার্থক্যের সমান হবে। কোনো ইলেক্ট্রন যদি উচ্চ শক্তি স্তর Eu থেকে একটি নিম্ন শক্তিস্তর El -এ গমন করে, তবে নিঃসৃত ফোটনের শক্তি হবে, hf=Eu –El । এখানে h হল প্লাঙ্কের ধ্রুবক এবং f হলো ফোটনের কম্পাঙ্ক।
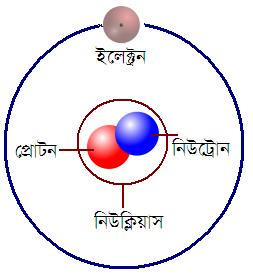 আধুনিক
মতবাদে প্রতিটি
পরমাণুর দুটি প্রধান দুটি অংশ রয়েছে। অংশ দুটি হলো
–
আধুনিক
মতবাদে প্রতিটি
পরমাণুর দুটি প্রধান দুটি অংশ রয়েছে। অংশ দুটি হলো
–
- ক. পরমাণুর ভিতরে সুস্থির একটি অংশ রয়েছে। সাধারণভাবে এর পরিচয় হলো নিউক্লিয়াস। এই নিউক্লিয়াসের সাধারণ দুই ধরনের কণা পাওয়া যায়। এই কণা দুটির নাম প্রোটোন ও নিউট্রোন। ব্যাতিক্রম: হাইড্রোজেন পরমাণুতে নিউট্রন নাই।
- খ. পরমাণুর বহিস্থ অংশ, যাতে ইলেক্ট্রন নামক কণা থাকে এবং নিউক্লিয়াসকে ঘিরে আবর্তিত হয়।
শক্তিস্তরে ইলেকট্রন বিন্যাস
বোরের মডেল অনুসারে জানা যায়, পরমাণুর
ইলেক্ট্রনগুলো
তাদের নিজ নিজ শক্তি অনুযায়ী বিভিন্ন
শক্তিস্তরে অবস্থান করে। এই শক্তিস্তরগুলোকে কয়েকটি সাংকেতিক নামে চিহ্নিত করা
হয়। এই নামগুলো হলো−
K, L, M, N, O, P, Q।
পরমাণুর কেন্দ্র থেকে এই
শক্তিস্তরগুলোকে ক্রমিক
(n)
সংখ্যা দ্বারা নির্ধারিত হয়। এই বিচারে শক্তিস্তরগুলোর মান হয়−
- K=n=1
- L=n=2
- M=n=3
- N=n=4
- O=n=5
- P=n=6
- Q=n=7
প্রতিটি শক্তিস্তরে ইলেক্ট্রনের সংখ্যা একটি গাণিতিক সূত্রে নির্ধরিত থাকে। সূত্রটি হলো 2n²। এখানে
- 2 হলো ধ্রুব মান
- n হলো পরমাণুর শক্তিস্তর মান
উল্লিখিতি দুটি ছকের বিচারে পরমাণুর শক্তিস্তরে ইলেক্ট্রনের সর্বোচ্চ ধারণ ক্ষমতা হয়−
- K শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×1² = 2 টি
- L শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×2² = 4 টি
- M শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×3² = 18 টি
- N শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×4² = 32 টি
- O শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×5² = 50 টি
- P শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×6² = 72 টি
- Q শক্তিস্তরে ইলেক্ট্রনের ধারণক্ষমতা 2×7² = 98 টি
১ থেকে ১৮ পারমাণবিক সংখ্যাবিশিষ্ট মৌলসমূহ অর্থাৎ হাইড্রোজেন থেকে আর্গন পর্যন্ত এই নিয়ম মেনে চলে। এই মৌলসমূহের ইলেকট্রনকে বিভিন্ন শক্তিস্তরে উপরের ধারণক্ষমতা অনুসারে সাজানো যায়। নিম্ন শক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ হলে পরবর্তী শক্তিস্তরে ইলেকট্রন প্রবেশ করে। পারমাণবিক সংখ্যা ১৯ থেকে অধিক পারমাণবিক সংখ্যাবিশিষ্ট মৌলের পরমাণুর ইলেকট্রন বিন্যাসের সময় তৃতীয় শক্তিস্তর পূর্ণ না হয়ে চতুর্থ শক্তিস্তরে ইলেকট্রন প্রবেশ করে।
সূত্র:
বাংলা একাডেমী বিজ্ঞান বিশ্বকোষ। ১-৫ খণ্ড।
http://en.wikipedia.org/wiki/Atom