 প্রোটন
প্রোটন ইংরেজি : Proton
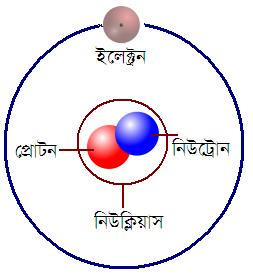
পরমাণুর একটি মৌলিক কণা। এই কণাটি একটি ধনাত্মক তড়িৎ আধান বহন করে। এর প্রতীক =p+ ।
এর ভর-
1.672621777(74)×10−27
kg।
পরমাণুর
তিনটি মৌলিক কণার মধ্যে একটি। অপর দুটি কণা হলো—
প্রোটন ও
নিউট্রন।
এটি একটি
অতিপারমাণবিক কণার
যৌগিক কণা। আধুনিক
পদার্থ বিজ্ঞানে প্রোটন হলো
হ্যাড্রোন
(hadron)-এর
অন্তর্গত
ব্যারিয়ন
শ্রেণির যৌগিক কণা।
এটি তিনটি
কোয়ার্ক কণা নিয়ে
তৈরি হয়। এর ভিতরে থাকে দুটি আপ কোয়ার্ক (up
quarks) এবং একটি ডাউন
কোয়ার্ক (down quark)।
দুটি আপ কোয়ার্কের আধান হলো- ২/৩+২/৩=৪/৩। পক্ষান্তরে এতে -১/৩যুক্ত
ডাউন কোয়ার্ক থাকায় এর চূড়ান্ত মান দাঁড়ায় ৪/৩-১/৩= ১। এই কারণে এর
প্রতীক
p+।
এই কোয়ার্কগুলো গ্লুয়োন শক্তি দ্বারা আবদ্ধ থাকে। এর ব্যাস ১.৬-১.৭
এফএম।
পরমাণুর
কেন্দ্রে এক বা একাধিক প্রোটন থাকে। একটি পরমাণুতে অবস্থিত
প্রোটনের সংখ্যাকে ওই পরমাণুর পারমাণবিক সংখ্যা বলা হয়। যেমন সোডিয়ামের
পরমাণুতে প্রোটন থাকে ১১টি। তাই সোডিয়ামের পারমাণবিক সংখ্যা ১১।
একটি পরমাণুতে প্রোটন ও নিউট্রনের সংখ্যাকে বলা হয় পারমাণবিক ভর
সংখ্যা (atomic
mass number)।
যেমন—কার্বনের
পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে। তাই এর পারমাণবিক ভর সংখ্যা
হবে ১২।
কোনো কোনো পদার্থের পরমাণুতে নিউট্রনের সংখ্যা প্রোটনের চেয়ে বেশি থাকতে দেখা যায়। ফলে ওই পদার্থের পারমাণবিক ভর সংখ্যা বৃদ্ধি পায়। যখন দুটি পরমাণুর পারামাণবিক সংখ্যা (প্রোটন সংখ্যা) একই থাকে, কিন্তু একটি পরমাণুর নিউট্রন সংখ্যা বেশি হয়, তখন ওই দুটি পরমাণুর পারামণিবক ভর সংখ্যা একই থাকে না। যে সকল পরমাণুর প্রোটন সংখ্যা একই থাকে কিন্তু নিউট্রন সংখ্যা ভিন্ন হয়, তখন ওই পরমাণুগুলো পরস্পরের আইসোটোপ হিসাবে বিবেচনা করা হয়। যেমন— কার্বনের পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৬টি থাকে, তাদের পরিচয় হয় কারন-১২ নামে। কিন্তু যখন কোনো পরমাণুতে প্রোটন ৬টি এবং নিউট্রন ৮টি থাকে, তখন তা কার্বন-১৪ নামে পরিচিত হয়। এই বিচারে কার্বন-১২ এবং কার্বন-১৪ পরস্পরের আইসোটোপ হবে।
আবার যখন একাধিক পরমাণুর নিউট্রন সংখ্যা একই থাকে, কিন্তু প্রোটন সংখ্যা ভিন্ন হয়, তখন তাদেরকে আইসোটোন (isotones) বলা হয়। যেমন- 1H2 এবং 2He3 পরস্পরের আইসোটোন। উভয় পরমাণুর নিউট্রন সংখ্যা ১টি কিন্তু পারমাণবিক ভর সংখ্যা ভিন্ন।
১৯২০ খ্রিষ্টাব্দে
রাদার্ডফোর্ড (Ernest
Rutherford) এর নামকরণ
করেন।
প্রোটন সুস্থির এবং অন্য কোনো কণার সাথে আবদ্ধ থাকাতে বাধ্য নয়। অন্যান্য কণার মতো প্রোটন সহজে ভেঙে যায় না। পরমাণুতে ইলেক্ট্রনের সাথে জোট বেঁধে থাকে। তবে পরিস্থিতি সাপেক্ষে প্রোটন স্বাধীনভাবে থাকতে দেখা যায়। বিশেষ করে উচ্চ তাপে বা শক্তি প্রয়োগে প্রোটন ইলেক্ট্রন থেকে পৃথক হয়ে যায়। আবার আয়োনিত পদার্থে প্রোটন পৃথক থাকে। এক্ষেত্রে উচ্চ তাপে বা শক্তি প্রয়োগে প্রোটন ও ইলেক্ট্রন মিলে পরমাণু তৈরি করতে পারে। কসমিক রশ্মিতে মুক্ত প্রোটন পাওয়া যায়।