এই পর্যায়ে পজিট্রন এবং ইলেকট্রন পরস্পরের সাথে সংঘর্ষ ঘটে এবং উভয়ই ধ্বংস হয়ে যায়। এই শক্তি দুটি গামা রাশ্ম ফোটন দ্বারা বাহিত হয়
|
e− |
+ |
e+ |
→ | 2 γ | + | 1.02 MeV |
|
প্রতীক
He
|
পৃথিবীর প্রাকৃতিক পরিবেশের বিচারে
এটি একটি দুষ্প্রাপ্য মৌলিক পদার্থ। মোট ছয়টি নিষ্ক্রিয় গ্যাসের ভিতর হিলিয়াম একটি।
স্বাভাবিক দশায় এই গ্যাস কোন যৌগ উৎপাদন করতে পারে না। প্রায়
নিষ্ক্রিয় গ্যাস হিসেবে একে মহার্ঘ গ্যাস হিসেবে উল্লেখ্য, ছয়টি মহার্ঘ
গ্যাসীয় মৌলিক পদার্থের ভিতরে হিলিয়াম একটি।
এই গ্যাসটি স্বাদহীন, বর্ণহীন, এবং রাসায়নিক সক্রিয়তা খুবই সামান্য। মহাবিশ্বের সবচেয়ে হাল্কা গ্যাস হিসাবে
স্বীকৃত গ্যাস হলো-
হাইড্রোজেন। হাল্কা গ্যাসের বিচারে হিলিয়ামের স্থান দ্বিতীয়। এর বাষ্পের ঘনত্ব এবং সান্দ্রতা সবচেয়ে কম। এর
বর্ণালী রেখা উজ্জ্বল হলুদ। এর তরঙ্গদৈর্ঘ্য ৫৮৭.৪৯ ন্যানোমিটার।
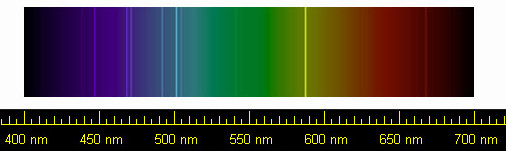
এর মোট আটটি আইসোটোপ আছে। এর ভিতর হিলিয়াম-৩ এবং হিলিয়াম-৪ সুস্থির।
মহাবিশ্বে জীবন্ত নক্ষত্রের অভ্যন্তরে হাইড্রোজেনের পারমাণবিক বিক্রিয়ার উপজাত পদার্থ হিসাবে হিলিয়াম তৈরি হয়ে থাকে। নক্ষত্র সৃষ্টির প্রাথমিক পর্যায়ে বস্তুপুঞ্জের সঙ্কোচনে (নক্ষত্রের ভ্রূণদশায়) পারস্পরিক সংঘর্ষে তাপমাত্রা বৃদ্ধি পেতে থাকে। এই তাপমাত্রা যখন প্রায় ১ কোটি কেলভিনে উন্নীত হয়, তখন বস্তপুঞ্জের অভ্যন্তরে নিউক্লীয় বিক্রিয়া শুরু হয়। এই সময় নক্ষত্রের অভ্যন্তরে প্রোটোন-প্রোটোন চক্র পদ্ধতিতে হাইড্রোজেন থেকে হিলিয়ামের রূপান্তর ঘটে। ২টি হাইড্রোজেন নিউক্লেই 1H (প্রোটোন) বিক্রিয়ায় অংশগ্রহণ করে। এর ফলে তৈরি হয় দুটি ডিউটোরিয়াম (D) -এ পরিণত হয়। একই সাথে তৈরি হয় একটি পজিট্রন এবং একটি নিউট্রিনো।
|
1 1H |
+ |
1 1H |
→ |
2 1D |
+ |
e+ |
+ |
ν e |
+ | 0.42 MeV |
|
e− |
+ |
e+ |
→ | 2 γ | + | 1.02 MeV |
দ্বিতীয় ধাপ : প্রথম ধাপে উৎপন্ন
দুটি ডিউটোরিয়াম
আরও একটি হাইড্রোজেনের সাথে মিলিত হয়ে তৈরি হয় হিলিয়াম (3He)-তে
পরিণত হয়। একই সাথে গামা রশ্মি এবং শক্তি নির্গত হয়।
|
2 1D |
+ |
1 1H |
→ |
3 2He |
+ | γ | + | 5.49 MeV |
তৃতীয় ধাপ: দ্বিতীয় ধাপে উৎপন্ন হিলিয়াম (3He)-এর সাথে একটি হাইড্রোজেন নিউক্লেই 1H (প্রোটোন) যুক্ত হয়ে হিলিয়াম (4He) উৎপন্ন হয়।
সব মিলিয়ে ৪টি হাইড্রোজেন মিলিত হয়ে হিলিয়াম (4He) তৈরি হওয়া পর্যন্ত যে ফলাফল পাওয়া যায়, তা হলো-
হিলিয়ামকে প্রথম বেলুন উড়ানোর জন্য ব্যবহার করা হতো। মূলত অতি উচ্চতায় আবহাওয়া সংক্রান্ত গবেষণার জন্য হিলিয়াম ভর্তি বেলুন ব্যবহার করা হয়। তরল-জ্বালানি ব্যবহারকারী রকেটের স্বাভাবিক বায়ুচাপ বজায় রাখার জন্য, ডুবুরিদের শ্বাস-প্রশ্বাস চালানোর জন্য হিলিয়াম-অক্সিজেনের মিশ্রণে, গ্যাস দ্বারা শীতলীকারী পারমাণবিক চুল্লিতে এই গ্যাস ব্যবহার করা হয়।
হিলিয়াম আবিষ্কারের ইতিহাস
ফরাসি বিজ্ঞান জুলেস জনসন (Jules Janssen)
এবং ইংরেজ জ্যোতির্বিজ্ঞানী নরম্যান লকিয়ার (Norman Lockyer)-কে
এই গ্যাসটির আবিষ্কারক হিসাবে মনে করা হয়। এর পিছনে কিছু বিভ্রান্তিকর গল্প তৈরি
হয়েছিল। গল্পটি চালু হয়েছিল ১৮৬৮ খ্রিষ্টাব্দে অনুষ্ঠিত সৌরগ্রহণের সূত্রে। জুলেস
জনসন প্যারিস এ্যাকাডেমি অফ সায়েন্সে একটি তারবার্তায় জানান-
'গ্রহণ এবং সৌরপ্রজ্জ্বলন লক্ষ্য করা হয়েছে, বর্ণালিটি অসাধারণ এবং অভূতপূর্ব, সৌরপ্রজ্জ্বলনটি গ্যাসীয় প্রকৃতির।'
মূলত এই সময় গ্রহণ দেখা গিয়েছিল ভারত মহাসাগরীয় অঞ্চলে। জুলেস
জনসন সে সময়ে ভারতমহাসাগরীয় অঞ্চলে ছিলেন না। তা ছাড়া সৌরপ্রজ্জ্বলন সম্পর্কে
বিজ্ঞানীদের তেমন সুষ্পষ্ট ধারণা ছিল না। মূলত তিনি সৌরপ্রজ্জ্বলন দেখেছিলেন অন্য
সময়। পক্ষান্তরে নরম্যান লকিয়ার ইংল্যান্ডে বসেই সৌরপ্রজ্জ্বলন
দেখেছিলেন বিশেষভাবে নির্মিত দূরবীক্ষণ যন্ত্রের সাহায্যে। উভয়ই প্যারিস এ্যাকাডেমি
অফ সায়েন্সে ভিন্ন ভিন্ন সময়ে তাঁদের পর্যবেক্ষণের বিষয়টি চিঠিতে লিখে পাঠিয়েছিলেন।
কাকতালীয়ভাবে উভয় চিঠি পৌঁছেছিল ১৮৬৮ খ্রিষ্টাব্দের ২৬ অক্টোবরে। উভয় চিঠি থেকে
জানা যায়, উভয়ই এই বর্ণালী লক্ষ্য করেছিলেন সাধারণভাবে সংঘটিত সূর্যের প্রজ্জ্বলন
লক্ষ্য করে। এরপর ইতালির বিজ্ঞানী এ. সেসি (A.
Secci)
এই রেখাকে গভীরভাবে পর্যবেক্ষণ করে এর নামককরণ করেন
D3।
সেসি মূলত এই রেখাকে হাইড্রোজেনের একটি বিশেষ ধরনের বর্ণালী হিসাবে বিবেচনা
করেছিলেন। এরপর নরম্যান লকিয়ার
এবং ই ফ্রকল্যান্ড এই
হাইড্রোজেন পরীক্ষা করে এইরকম কোন বর্ণালীর সন্ধান পেতে
ব্যর্থ হন। ১৮৭১ খ্রিষ্টাব্দের ৩ এপ্রিলে এই বর্ণালির জন্য এক্স নামক কোনো নতুন মৌল
দায়ী বলে দাবি করেন।
ফ্রাকল্যান্ড গ্রিক শব্দ হেলিয়াস (সৌর) শব্দের অনুসরণে এই
অজ্ঞাত মৌলের নাম 'হিলিয়াম' রাখার প্রস্তাব করেছিলেন। ৩ আগষ্ট তারিখে ব্রিটিশ
এ্যাসোসিয়েশনের সভায় এর সভাপতি ভি. থমসন (লর্ড কেলভিন) এর অজ্ঞাত মৌলটির নাম
'হিলিয়াম' হিসাবে উল্লেখ করেন।
১৮৯৫ খ্রিষ্টাব্দের ১ ফেব্রুয়ারি কে মিয়ের্স নামক
ব্রিটিশ জাদুঘরের এক কর্মীর কাছ থেকে ডব্লু র্যামেজ একটি ছোটো চিঠি পান। উল্লেখ্য,
র্যামেজ তখন আর্গন আবিষ্কারের জন্য যথেষ্ঠ খ্যাতি লাভ করেছিলেন। এই চিঠিতে তিনি
হিল্ডেব্রান্ড-এর
১৮৯০ খ্রিষ্টাব্দের একটি গবেষণার কথা জানান। এই চিঠি থেকে
র্যামেজ জানতে পারেন যে, হিল্ডেব্রান্ড থোরিয়াম এবং ইউরেনিয়াম খনিজকে (ক্লেভাইট
জাতীয় পদার্থ) উত্তপ্ত করে কিছু নিষ্ক্রিয় গ্যাসের সন্ধান পেয়েছেন। এরপর র্যামেজ ৫
ফেব্রুয়ারিতে গবেষণার ব্যবস্থা করেন। কিন্তু তিনি আর্গন নিয়ে তখনও গবেষণায় ব্যস্ত
থাকায়, তিনি তাঁর ছাত্র ডি.ম্যাথুসকে গবেষণার দায়িত্ব দেন। ম্যাথুস গরম সালফিউরিক
এ্যাসিডে ক্লেভাইট সিক্ত করলে গ্যাসের বুদ্বুদ লক্ষ্য করেন। র্যামেজ এই গ্যাসটি
সংগ্রহ করে বর্ণালী পরীক্ষা করে একটি নতুন গ্যাসের অস্তিত্বের কথা বিবেচনা করেন। ২২
মার্চ তিনি এই গ্যাসটি সম্পর্কে বি. ব্রাউনারকে জানান। ব্রাউনার এই নতুন গ্যাসটির
নামকরণ করেন ক্রিপ্টন। কিন্তু এই নামটি আগেই অন্য মৌলের জন্য রাখা হয়েছে, তাই এই
নামটি বাতিল হয়ে যায়। এরপর র্যামেজ তাঁর প্রতিবেদন ক্রুক্স-এর কাছে পাঠান। ১৮৯৫ খ্রিষ্টাব্দে
ক্রুকসের সম্পাদিত 'কেমিক্যাল নিউস' পত্রিকায় হিলিয়াম সম্পর্কে র্যামেজের বিস্তারিতভাবে
ব্যাখ্যা করেন। একই সময় সুইডিশ রসায়ন বিজ্ঞানী এবং তাঁর সহকর্মী এ ল্যাংলেট হিলিয়াম আবিষ্কার
করেছিলেন ক্লেভাইট খনিতে।
১৯৯৮ খ্রিষ্টাব্দে বায়ুমণ্ডলে হিলিয়ামের সন্ধান পাওয়া যায়।
সাধারণভাবে হিলিয়ামের নিউক্লিয়াসকে বলা হয়-
আলফা কণা।
সূত্র :
রাসায়নিক মৌল। দ,ন, ত্রিফোনভ, ভ.দ. ত্রিফোনভ। মির প্রকাশন, ১৯৮৮।
বাংলা একাডেমী বিজ্ঞান বিশ্বকোষ। দ্বিতীয় খণ্ড। কার্তিক ১৪০৬/নভেম্বর ১৯৯৯।